
МАЙСТЕР – КЛАС
«ВИКОРИСТАННЯ ВІРТУАЛЬНОЇ ХІМІЧНОЇ ТА БІОЛОГІЧНОЇ ЛАБОРАТОРІЇ ПРИ ПРОВЕДЕННІ ПРАКТИЧНИХ РОБІТ»
18 грудня 2014 року на базі Шелестівського НВК відбулося засідання РМО вчителів біології та хімії за темою «ВИКОРИСТАННЯ ВІРТУАЛЬНОЇ ХІМІЧНОЇ ТА БІОЛОГІЧНОЇ ЛАБОРАТОРІЇ ПРИ ПРОВЕДЕННІ ПРАКТИЧНИХ РОБІТ», яку висвітлив Завгородній Сергій Іванович. За допомогою ППЗ було продемонстровано методику виконання учнями практичних робіт з біології та хімії. Колеги ознайомились з можливостями «Віртуальної лабораторії» та інших програмних засобів, мали змогу самі попрацювати з цими програмами, щоб надалі використовувати ППЗ на власних уроках. Було прийнято рішення більш широко впроваджувати такі методи і форми роботи при викладанні матеріалу, а особливо при виконанні практичних робіт.
План-конспект уроку з хімії у 7 класі
Тема. Поширення Феруму в природі. Використання заліза. Руйнування (іржавіння) заліза в природних умовах
Цілі: закріпити знання про фізичні та хімічні властивості заліза; ознайомити учнів з поширеністю Феруму в природі, використанням заліза; поглибити знання учнів про хімічні явища на прикладі іржавіння заліза; познайомити учнів зі способами захисту від корозії.
Тип уроку: засвоєння нових знань, умінь і навичок.
Форми роботи: самостійна робота з опорною схемою, групова робота з підручником, фронтальна бесіда.
Обладнання: періодична система хімічних елементів, картки із завданнями.
ХІД УРОКУ
І. Організація класу
II. Актуалізація опорних знань
Фронтальна бесіда
• В якій групі періодичної системи знаходиться хімічний елемент Ферум? (VIII група, побічна підгрупа)
• До якого типу хімічних елементів належить Ферум? (До металів)
• Які фізичні властивості відрізняють метали від неметалів? (Металевий блиск, тепло- й електропровідність, ковкість, пластичність та ін.)
• Що таке сплави? {Це суміші металів)
• Які хімічні властивості заліза ми вивчили? (Взаємодія з киснем і сіркою)
III. Засвоєння нових навичок знань
Учні об'єднуються в групи для спільного виконання завдання.
Знайдіть у підручнику відповідь на запитання.
Група 1. Поширення заліза і Феруму в природі.
Група 2. Способи одержання заліза.
Група 3. Використання і значення заліза.
Група 4. Руйнування заліза в природних умовах.
Група 5. Способи захисту від корозії.
Після вивчення відповідного розділу підручника і консультації вчителя учні складають відповідь на запитання представник кожної групи розповідає біля дошки про результати роботи групи. Учитель робить узагальнюючий висновок
1. Залізо — один з найбільш поширених у природі елементів: за вмістом у земній корі — 4,7 % (масових). Зустрічається у вигляді оксидів і сульфідів, сконцентрованих у вигляді родовищ, придатних для промислової розробки.
Найважливіші руди:
• бурі залізняки (НFеO2 x Н20), пірит FеS2;
• червоні залізняки (Fе2O3);
• магнітні залізняки (Fе3O4);
• шпатові залізняки (FеСO3):
Більшість із них жовто-бурі, коричневі, бурі й темно-червоні.
2. Одержують залізо з руди на металургійних заводах. Відновлюють з оксидів вугіллям, карбон (ІІ) оксидом або воднем. Запишемо рівняння реакції.
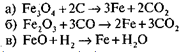
(Тип реакцій а), в) — заміщення: одна проста речовина заміщає в складній сполуці іншу.)
3. Широко використовується в техніці завдяки своїм властивостям і легкості одержання. Має дуже важливе значення для людини. На частку заліза та його сплавів припадає близько 95 % усіх вироблених у світі металів. Але не тільки техніка має потребу в залізі. Без заліза не могло б існувати життя у звичній для нас формі: двовалентний Ферум міститься в гемоглобіні крові — речовині, що забезпечує насичення живих тканин киснем.
4. 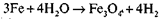
У вологому повітрі за звичайної температури залізо легко окиснюється, вкриваючись рихлою іржею (її склад —Fе203 • nН20). Унаслідок своєї пористості іржа не перешкоджає доступу кисню і вологи до металу, тому залізо руйнується. За деякими даними, у XIX столітті від корозії загинула половина всього виробленого заліза.
5. Корозія — хімічне або електрохімічне руйнування металів під впливом навколишнього середовища.
Сьогодні розроблено способи боротьби з корозією:
• покриття фарбою;
• нікелювання заліза;
• оцинковування заліза;
• покриття емаллю;
• покриття антикорозійними оліями та ін.
IV. Підбиття підсумків уроку Тестова робота за варіантами
Варіанті
1. Хімічна формула простої речовини заліза:
а) Fе3;
б) FеО;
в) Fе.
2. Формула ферум(III) оксиду:
а) Fе3O4;
б) Fе2O3;
в) FеО.
3. Дано рівняння реакції:
Fе + O2 = Fе3O4
Сума коефіцієнтів у рівнянні: а) 3; 6) 9; в) 6.
4. Масова частка Феруму у ферум (П) оксиді:
а) 77,8 %;
6)70,0%;
в) 79,4%.
5._________ використовується:
• у медицині;
• у техніці;
• у побуті тощо.
Варіант II
1. Хімічний символ елемента Ферум:
а) Ni
б)Fе;
в) Мg.
2. Формула ферум(ІІ) оксиду:
а) Fе3O4;
б) Fе2O3;
в) FеО.
3. Дано рівняння реакції:
Fе + O2 = Fе2O3
Сума коефіцієнтів у рівнянні: а) 3; 6) 6; в) 9.
4. Масова частка Феруму у ферум(ПІ) оксиді:
а) 77,8 %;
б) 70,0 %;
в) 72,4 %.
5._______ зустрічається в природі у вигляді:
• оксидів;
• простої речовини;
• сульфідів та ін.
Виставляємо оцінку за урок з урахуванням роботи в групах і тестів.
V. Домашнє завдання
Прочитати параграф про властивості заліза, відповісти на запитання.

